Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Sclérose en plaques : activer des récepteurs lymphocytaires pour atténuer la maladie
- Tweeter
-
-
0 avis :
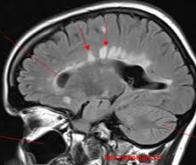
Dans les maladies auto-immunes, un dysfonctionnement des mécanismes de défense de l’organisme conduit les médiateurs de l’immunité à se retourner contre certaines cellules du malade. Dans la sclérose en plaques (SEP) par exemple, les lymphocytes T dits effecteurs (Teff) s’attaquent à la gaine de myéline.
Or, d’autres lymphocytes T, dits régulateurs (ou Treg), ont été décrits comme capables de moduler l’activité des Teff. Leur absence conduit d’ailleurs à une aggravation des symptômes dans un modèle animal de la SEP, l’encéphalomyélite auto-immune expérimentale (EAE). Reste que la façon dont ces cellules régulatrices interviennent est encore mal connue. Une équipe de chercheurs dirigée par Benoît Salomon s’est penchée sur la question, en collaboration avec Yenkel Grinberg-Bleyer : elle a observé que l’action protectrice des Treg dans le système nerveux central est augmentée lorsqu’une protéine de l’inflammation, le TNF, se fixe à l’un de leurs récepteurs spécifiques, le TNFR2. Ces travaux pourraient aboutir à de nouvelles approches thérapeutiques contre la SEP.
Le TNF est impliqué dans les mécanismes délétères de plusieurs maladies auto-immunes qui, de fait, sont traitées par des médicaments anti-TNF. Pourtant, ces traitements sont contre-indiqués dans la SEP car ils peuvent en aggraver les symptômes. « Le TNF aurait donc un rôle pro ou anti-inflammatoire, selon le contexte. Cela peut en partie s’expliquer par l’existence de deux types de récepteurs du TNF sur les cellules immunitaires : TNFR1, principalement connu comme médiateur de l’inflammation, et TNFR2, fortement exprimé par les Treg, plus volontiers identifié comme un régulateur », explique Benoît Salomon. « Nous avons posé l’hypothèse que, dans la SEP, les anti-TNF pourraient bloquer l’action protectrice des Treg qui expriment le TNFR2 ».
Pour étudier cette possibilité, le chercheur et son équipe ont comparé l’évolution de la maladie chez des souris atteintes d’EAE qui présentaient ou non des récepteurs TNFR2 opérationnels à la surface de leurs Treg. Ils ont ainsi fait deux observations : tout d’abord, en l’absence de récepteurs TNFR2 fonctionnels, les souris malades adoptent une forme très sévère d’EAE. Par ailleurs, le mécanisme auto-inflammatoire qui en découle n’est observé qu’au niveau du système nerveux central, c’est-à-dire une fois que la maladie est devenue symptomatique : « Dans une maladie auto-immune, la première phase – asymptomatique – se déroule dans les ganglions lymphatiques, là où les premiers lymphocytes B ou T auto-réactifs sont activés au contact d’antigènes du malade. Nos travaux montrent que la modulation exercée par les Treg reste stable pendant cette phase, que les récepteurs TNFR2 soient fonctionnels ou non. En revanche, dans le système nerveux central, les cellules régulatrices déficientes pour le TNFR2 perdent une partie de leur capacité à contrôler la maladie. Le rôle des Treg semble donc primordial lors de la seconde phase de la maladie, celle où les symptômes sont présents ».
Enfin, les chercheurs ont pu montrer qu’il est possible d’atténuer les symptômes d’une souris atteinte d’EAE grâce à l’administration d’une molécule expérimentale, activatrice des récepteurs TNFR2. « On peut imaginer le développement de deux nouvelles familles de médicaments contre la SEP : des anticorps qui seraient capables de bloquer les récepteurs TNFR1, afin de limiter le phénomène inflammatoire, et d’autres qui activeraient les TNFR2, et donc la régulation de l’inflammation », suggère Benoît Salomon.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :

Un simple test buccal pour prédire le risque de mortalité
Un test ADN, initialement conçu pour mesurer le vieillissement biologique à partir de cellules prélevées dans la joue, pourrait un jour révéler combien de temps il nous reste à vivre. Des chercheurs ...
Vers de nouveaux antibiotiques « anti-résistance »
Des chercheurs de l’Université de Harvard ont mis au point une nouvelle molécule synthétique très efficace contre les bactéries résistantes aux antibiotiques actuellement disponibles. C’est donc ...
Edito : Ces virus qui provoquent le cancer...et qui le soignent...
Il y a quelques années, au cours d'un débat télévisé, un scientifique avait demandé aux participants quels étaient, selon eux, les principaux facteurs responsables du cancer. De manière prévisible, ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :