Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
La palmitylation, une nouvelle cible pour les médicaments contre le cancer
- Tweeter
-
-
0 avis :
Les protéines membranaires périphériques ont la particularité de se lier temporairement aux membranes cellulaires, étape obligatoire pour qu’elles puissent ensuite remplir leur fonction biologique. Pour ce faire, certaines enzymes servant à catalyser leur modification lipidique entrent en action. Ce processus se nomme "palmitylation". Or, certaines protéines peuvent muter pour devenir oncogènes, et notamment les protéines RAS, responsables d’environ un tiers des cancers.
Afin de comprendre le fonctionnement de la palmitylation et de l’utiliser à des fins thérapeutiques, des scientifiques de l’Université de Genève (UNIGE) ont développé un nouvel outil pour visualiser ce processus dans les cellules vivantes. Et contrairement à ce que l’on pensait, la palmitylation est possible non seulement dans l’appareil de Golgi, site habituel de traitement et d’administration des protéines, mais aussi à l’endroit précis où la protéine doit agir. Cette découverte ouvre la voie à des stratégies innovantes de développement de médicaments afin de cibler très précisément la liaison membranaire – et donc l’activité – des protéines favorisant l’apparition de cancers.
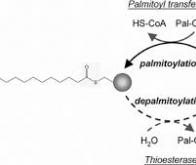
La palmitylation consiste à introduire des acides gras dans certaines protéines afin qu’elles puissent se lier aux membranes cellulaires. Ce mécanisme est régi par des règles précises qui dépendent de la séquence de chaque type de protéine, et de la présence d’enzymes spécialisées. Jusqu’à présent, la communauté scientifique pensait que la palmitylation des protéines membranaires périphériques ne pouvait avoir lieu qu’à un seul endroit de la cellule, l’appareil de Golgi.
« En effet, ces protéines sont produites dans le cytosol – le liquide cellulaire – puis "nagent" jusqu’à l’appareil de Golgi, où elles sont modifiées avant d’être transportées là où elles doivent agir », explique Gonzalo Solis, chercheur au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l’UNIGE et premier auteur de ces travaux. « Notre hypothèse était cependant qu’une palmitylation locale était possible, sans passer par l’appareil de Golgi. Si cela se vérifie, de toutes nouvelles possibilités d’intervention sur ce mécanisme s’ouvrent alors ».
Pour tester son hypothèse, l’équipe de recherche menée par Vladimir Katanaev, professeur au Département de physiologie et métabolisme et au Centre de recherche translationnelle en onco-hématologie de la Faculté de médecine de l’UNIGE, s’est penchée sur une protéine appelée Gαo, située au niveau de la membrane plasmique et de l’appareil de Golgi.
La méthodologie utilisée est entièrement inédite : « Nous avons transporté les enzymes responsables de la palmytilation ailleurs que dans l’endroit habituel, en l’occurrence dans l’enveloppe du noyau cellulaire », explique Gonzalo Solis. « Gαo était alors activée dans la membrane nucléaire, ce qui nous a permis d’identifier l’enzyme spécifique en charge de sa palmytilation, confirmant ainsi que ce processus peut avoir lieu sur le site même où la protéine est nécessaire ».
Contrairement aux méthodologies biochimiques habituelles, l’outil développé par Vladimir Katanaev et son équipe, baptisé SwissKASH, est le premier à maintenir la cellule en vie pour observer le processus de manière dynamique. « Jusqu’ici, il n’y avait pas d’autre solution que de détruire la cellule », explique Vladimir Katanaev. « Notre méthode permet également de déterminer exactement quelle protéine réagit à quelle enzyme localement, un élément essentiel si l’on veut contrôler ce mécanisme à des fins thérapeutiques ».
Plusieurs protéines membranaires périphériques, et notamment les protéines à sous-unités Gα et les protéines RAS, sont susceptibles de muter et acquièrent alors un potentiel oncogénique agressif. Or, leur oncogénicité dépend de leur capacité à se lier à la membrane plasmique ; la palmitylation joue donc un rôle clé dans la transformation d’une cellule saine en cellule cancéreuse. « Inhiber l’enzyme qui induit la palmitylation pour empêcher la protéine oncogénique de se lier à la membrane plasmique pourrait donc désamorcer son pouvoir pathogène », souligne Gonzalo Solis. « On peut imaginer bloquer cette réaction spécifique sans déséquilibrer l’ensemble du système ». Les scientifiques vont maintenant chercher à automatiser cette méthodologie pour étudier l’effet de toute une série de produits pharmaceutiques sur la palmitylation d’une sélection d’oncoprotéines, ainsi que pour tester leur toxicité sur l’ensemble de la cellule.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :
Des chercheurs réussissent à modifier pour la première fois le génome de bactéries directement dans l’intestin
C'est une première mondiale : une équipe de recherche de l’entreprise biotechnologique française Eligo Bioscience a mis au point une technique de modification de génomes bactériens par ADN ...

Cancer de la prostate : une alimentation saine peut limiter l’aggravation de la maladie
Des chercheurs de l’université John Hopkins, aux États-Unis, ont montré qu’une alimentation saine peut limiter le risque d’aggravation du cancer de la prostate. Cette maladie peut être classée selon ...
AVC : des chercheurs français découvrent une nouvelle piste de traitement très prometteuse
Des chercheurs de l’Inserm de Caen travaillent sur une nouvelle piste visant à repérer et détruire les caillots de sang responsables des AVC. Cette équipe a synthétisé des particules baptisées ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :