Matière
- Matière et Energie
- Chimie
Une nouvelle enzyme synthétisée par hasard dégrade efficacement le plastique
- Tweeter
-
-
5 avis :
Chaque année, 9 millions de tonnes de déchets plastiques non traités sont rejetés dans les océans, ce qui entraîne une importante pollution planétaire et perturbe de plus en plus les écosystèmes marins. En 2016, en analysant des échantillons de sol d’une usine de recyclage de plastique, une équipe de biologistes japonais de l’Université de Kyoto a découvert l’existence d’une bactérie nommée « Ideonella sakaiensis ».
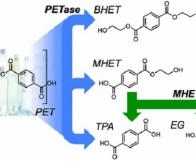
La particularité de cette dernière réside dans le fait qu’elle ait évolué afin de pouvoir dégrader et utiliser le plastique PET (téréphtalate d’éthylène) comme source de carbone et d’énergie. En étudiant Ideonella sakaiensis et ses mécanismes cellulaires, les scientifiques ont accidentellement synthétisé une nouvelle enzyme bien plus performante que celle utilisée par la bactérie et qui pourrait offrir une véritable solution à la déferlante plastique actuelle.
Comme le souligne John McGreehan, biologiste structural à l’Université de Portsmouth (Royaume-Uni), « Cette découverte non anticipée suggère qu’il est possible d’améliorer davantage ces enzymes, nous rapprochant d’une solution de recyclage pour chaque montagne de déchets plastiques ».
L'équipe de McGreehan, incluant des chercheurs de l’US Department of Energy’s National Renewable Energy Laboratory (NREL), ont synthétisé la nouvelle enzyme en étudiant la structure cristalline de la PETase – l’enzyme permettant à Ideonella sakaiensis de dissoudre le plastique PET.
Là où la PETase de Ideonella sakaiensis permet une dégradation en quelques semaines maximum, la nouvelle PETase améliorée ramène ce délai à quelques jours. « Après seulement 96h, nous pouvons clairement voir au microscope électronique que la PETase dégrade le PET ; et nous la testons avec de véritables déchets plastiques, tels que ceux trouvés dans les océans ou les décharges » indique le biologiste Bryon Donohoe (NREL).
Les auteurs ont tenté de modifier la PETase pour la rapprocher du mécanisme enzymatique de la cutinase – une enzyme dégradant la cutine, un biopolymère lipidique présent chez les plantes et dont la structure ressemble à celle du PET. En raccourcissant les liaisons entre les sites actifs de la PETase, ils se sont aperçus que la catalyse du plastique obtenu était bien plus performante que prévu.
Un important travail attend encore les scientifiques avant que cette nouvelle enzyme puisse être produite en masse et permette véritablement d’offrir une méthode de recyclage à grande échelle. Cependant, maintenant que l’on connaît son fonctionnement, son utilisation n’est plus qu’une question de temps.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :

Une technologie révolutionnaire pour extraire du lithium pur à 99,5 %, à partir de l’eau !
EnBW et LevertonHELM ont présenté un nouveau procédé de production de lithium respectueux de l’environnement et peut-être sur le point de révolutionner l’industrie européenne des batteries ...

Du CO2 à l'acétaldéhyde : vers une chimie industrielle plus verte
L’acétaldéhyde est un produit chimique essentiel utilisé dans la fabrication de nombreux produits, des parfums aux plastiques. Aujourd’hui, sa production repose en grande partie sur l’éthylène, un ...

Vers des sacs plastique entièrement biodégradables grâce à la chimie supramoléculaire
Des chercheurs japonais de l'université de Tokyo ont conçu un plastique supramoléculaire totalement soluble dans l'au de mer. La chimie supramoléculaire est une des branches de la chimie qui repose ...
Recommander cet article :
- Nombre de consultations : 585
- Publié dans : Chimie
- Partager :