Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Un nouvel outil pour mesurer les liaisons protéiques à l’échelle de la molécule unique
- Tweeter
-
-
0 avis :
Des processus essentiels se déroulant au sein du corps humain, tels que les réactions enzymatiques, la liaison des anticorps ou la réponse aux médicaments, dépendent de liaisons temporaires entre protéines. Bien qu’il soit difficile de caractériser ces liaisons en raison précisément de leur caractère fugace, il est important de le faire, pour tester par exemple les performances de thérapies potentielles. Cependant, les méthodes actuelles ont des capacités limitées quand il s’agit de caractériser une unique liaison. Elles reposent en effet sur des techniques de pointe, comme les pinces optiques ou magnétiques, qui ne permettent pas d’acquérir des données de façon parallèle pour en augmenter le débit, ou de réaliser une calibration précise de chaque mesure.
Dans un travail récent, des chercheurs et chercheuses du laboratoire Adhésion et inflammation (LAI, Aix-Marseille Université / CNRS / INSERM), en collaboration avec le Centre de Recherche en Cancérologie de Marseille (CRCM, Aix-Marseille Université / CNRS / INSERM / Institut Paoli-Calmettes) et l’Institut de biologie de l’École Normale Supérieure (IBENS, ENS-PSL / CNRS / INSERM) ont présenté une méthode surmontant ces obstacles, pour mesurer de façon plus accessible la résistance et la durée des liaisons protéine-protéine soumises à des forces similaires à celles qu'elles subiraient à l'intérieur de notre corps.
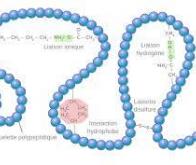
La méthode combine la spectroscopie de force acoustique et des structures de brins d’ADN. Les paires de protéines sont attachées à des structures d’ADN dans une chambre microfluidique. Un brin d'ADN attache la première protéine au fond de la chambre, tandis qu'un autre brin attache la seconde protéine à une petite bille de silice. Lorsque les chercheurs génèrent une onde acoustique dans la chambre, la force due à l'onde éloigne la bille de silice et la protéine à laquelle elle est attachée du fond de la chambre.
Si la force est suffisante, cette traction rompt le lien entre les deux protéines. L’originalité de cette méthode vient de ce qu’un troisième brin d'ADN agit comme une laisse pour maintenir les protéines proches l'une de l'autre après la rupture de leur lien, et permet aux chercheurs de voir se recommencer le processus de liaison/séparation un grand nombre de fois. Ils accèdent ainsi de façon statistiquement fiable aux caractéristiques énergétiques de chaque liaison, qui sont testées individuellement, et de leur éventuelle évolution en présence d’anticorps ou de médicaments, ou sous l’action d’un changement spontané de leur conformation.
Comme preuve de concept, l'équipe de recherche a utilisé la technique pour caractériser deux interactions moléculaires d'intérêt biomédical : la liaison entre les protéines et la rapamycine, un médicament immunosuppresseur, et la liaison entre un anticorps à domaine unique et un antigène du VIH-1.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :
Une bactérie pour soigner le cancer du côlon
Des chercheurs anglais et écossais ont découvert comment la Salmonella, à l’origine de l’infection salmonellose, empêchait les cellules T, des cellules immunitaires clés pour protéger l’organisme ...

Des probiotiques et de la vitamine D contre la Schizophrénie
On estime que 600.000 personnes sont atteintes de schizophrénie en France. Cette maladie psychiatrique, qui débute généralement chez les adolescents ou les jeunes adultes, se caractérise par des ...
Cancer du pancréas : un nouveau protocole augmente sensiblement la survie...
C'est peut-être un tournant dans la lutte contre ce cancer qui reste difficile à traiter : selon une nouvelle étude menée par des chercheurs du Yale Cancer Center (YCC) et de la Yale School of ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :