Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Un nouvel outil pour désactiver les gènes des maladies à prions
- Tweeter
-
-
0 avis :
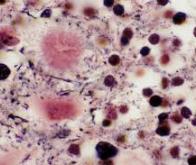
On sait que le mauvais repliement de protéines prions qui forment alors des agrégats provoquent la destruction des neurones. La formation de telles plaques protéiques toxiques est aussi impliquée dans d’autres maladies neurodégénératives comme Alzheimer. Une piste thérapeutique prometteuse consiste à désactiver les gènes responsables de la synthèse de ces protéines, par le biais d’un processus de régulation génétique appelé « extinction de gène ». Dans une étude récente, Edwin Neumann, du MIT (l’institut de technologie du Massachusetts), aux États-Unis, et ses collègues proposent un nouvel éditeur épigénétique capable d’empêcher l’expression d’une protéine prion dans les cerveaux de souris – une approche qui renouvelle l’espoir de développer des traitements efficaces contre les maladies neurodégénératives.
En 2021, de précédentes recherches fondées sur l’usage d’un éditeur épigénétique, CRISPRoff, s’étaient révélées prometteuses chez des souris, mais leur efficacité clinique avait ensuite été décevante. En effet, cette approche emploie des vecteurs viraux pour acheminer le complexe d’édition jusqu’au cerveau, mais CRISPRoff était trop large pour être transporté par un seul vecteur viral, et l’usage de plus grandes doses de vecteurs (permettant l’assemblage in situ du complexe d’édition) peut être toxique pour les cellules et engendrer des réponses immunitaires délétères.
Pour pallier ce problème, les biologistes ont mis au point un nouvel éditeur épigénétique, plus compact et programmable, qu’ils ont baptisé CHARM (Coupled histone tail for autoinhibition release of methyltransferase). Celui-ci s’insère sans difficulté dans un vecteur viral et est capable de cibler des gènes spécifiques avec un très grand niveau de spécificité par le biais d’une méthylation – une modification chimique appliquée à l’ADN, qui régule l’expression des gènes – dont les paramètres peuvent être programmés.
Comme cette approche est très précise et ne requiert pas de modification directe des séquences d’ADN, elle est beaucoup moins toxique pour les cellules. En mettant ce complexe à l’épreuve, Edwin Neumann et ses collègues ont diminué de 80 % l’expression des gènes à l’origine de la synthèse des protéines prions dans le cerveau de souris atteintes d’un modèle de maladie à prions. Mieux encore, le complexe CHARM était ensuite capable de se désactiver lui-même une fois son travail accompli, limitant ainsi le risque d’effets secondaires et de potentielle toxicité pour les cellules.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :

Un ancien médicament contre le diabète s'avère efficace contre l'insuffisance cardiaque
En France, on estime qu'un million et demi de personnes souffrent d'insuffisance cardiaque et que cette pathologie entraîne 70 000 décès chaque année. Cette incapacité soudaine du cœur à pomper ...
Un virus serait responsable de l'apparition du diabète de type 1
En France, 10 % des diabétiques sont touchés par un diabète de type 1. Chez ces patients, une production insuffisante d’insuline entraîne une élévation prolongée de la concentration de glucose dans ...
Des «avatars» pour traiter le lymphome de manière personnalisée
Le cancer est une maladie complexe et multiforme, chaque tumeur répond à des thérapies différentes. C'est également le cas des lymphomes, un type de cancer du sang qui prend naissance dans les ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :