Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Le cuivre à l’origine de modifications épigénétiques favorisant les cancers
- Tweeter
-
-
1 avis :
L'inflammation est un processus biologique complexe qui permet l'élimination des pathogènes et la réparation des tissus endommagés. Cependant, une dérégulation du système immunitaire peut conduire à une inflammation incontrôlée qui entraîne des lésions et qui contribue à des processus pathologiques. C’est le cas du cancer où le rôle de l’inflammation est avéré dans la progression tumorale. Or, les mécanismes moléculaires sous-jacents à l’inflammation restent encore mal connus aujourd’hui et, de fait, le développement de nouveaux médicaments représente un défi considérable.
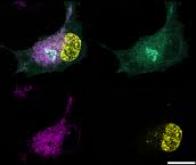
En 2020 déjà, le Docteur Raphaël Rodriguez, directeur de recherche au CNRS et chef de l’équipe Chemical Biology à l’Institut Curie (Equipe Labellisée Ligue Contre le Cancer) au sein du laboratoire Chimie et biologie de la cellule (Institut Curie/ CNRS/ Inserm), avait apporté un éclairage nouveau sur un récepteur membranaire appelé CD44, qui marque la réponse immunitaire, l’inflammation et le cancer en particulier. Le chercheur et son équipe avaient ainsi montré que CD44 permettait le transport du fer dans la cellule, déclenchant alors une série de réactions conduisant à l’activation de gènes impliqués dans le processus métastatique.
Aujourd’hui, avec ses collègues, le Docteur Rodriguez vient de franchir une nouvelle étape. Les chercheurs ont en effet réussi à identifier une voie de signalisation impliquant le cuivre et conduisant à l’expression des gènes de l’inflammation dans les macrophages, des cellules qui sont présentes dans tous les tissus et qui jouent un rôle majeur dans la réponse immunitaire innée.
Une fois internalisé dans les macrophages, le cuivre pénètre dans les mitochondries (les organites responsables de la respiration cellulaire), où il catalyse l’oxydation du NADH en NAD+ (nicotinamide adénine dinucléotide, une molécule nécessaire à l’activité de certaines enzymes). L’augmentation de NAD+ dans les cellules permet l’activation d’autres enzymes, impliquées dans la production de métabolites essentiels à la régulation épigénétique. Ces métabolites permettent alors l’activation des gènes impliqués dans l’inflammation.
Les scientifiques ne se sont pas contentés de cette découverte : ils ont également conçu des molécules capables de se lier au cuivre, inspirées de la metformine. En les testant sur des modèles d’inflammation aigüe d’origine virale ou bactérienne, ils ont identifié qu’une molécule de synthèse de la metformine, LCC-12 (aussi nommée Supformine), réduisait l’activation des macrophages et atténuait l’inflammation. Leurs travaux leur ont permis de développer un prototype de médicament qui inactive le cuivre dans la machinerie métabolique de la cellule, bloquant ainsi l’expression des gènes impliqués dans l'inflammation
Pour finir, ils ont appliqué cette stratégie thérapeutique sur des cellules cancéreuses engagées dans une transition épithélio-mésenchymateuse. Là encore, la Supformine a mis un frein au mécanisme cellulaire et donc à la transformation des cellules. « Les gènes activés au sein des cellules cancéreuses ne sont pas les mêmes que ceux impliqués dans les cellules immunitaires, mais la réaction en chaîne qui conduit aux modifications épigénétiques est identique », explique le Docteur Rodriguez. Ces résultats mettent ainsi en évidence le rôle du cuivre des cellules cancéreuses et leur capacité à adopter un caractère métastatique. Comme le souligne le Docteur Raphaël Rodriguez, « Notre étude révèle finalement que les processus inflammatoires et cancéreux dépendent de mécanismes moléculaires semblables et pourraient donc bénéficier dans le futur de thérapies innovantes similaires, telles que celle testée avec le Supformine ».
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :

Le lait maternel pourrait s'avérer efficace pour lutter contre le cancer
Une étude révèle qu'un composant du lait maternel, connu pour ses propriétés anti-inflammatoires, pourrait être utilisé comme agent thérapeutique pour des maladies. Bénéfique pour la santé des bébés,...

Le curcuma pourrait réduire les risques de DMLA
La DMLA reste un défi thérapeutique, notamment dans sa forme sèche. Une étude observationnelle suggère que le curcuma pourrait diminuer le risque de développer une DMLA, ralentir sa progression et ...
Des chercheurs réussissent à modifier pour la première fois le génome de bactéries directement dans l’intestin
C'est une première mondiale : une équipe de recherche de l’entreprise biotechnologique française Eligo Bioscience a mis au point une technique de modification de génomes bactériens par ADN ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :