Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Les cellules cancéreuses détournent la structure 3D de l'ADN
- Tweeter
-
-
0 avis :
Dans le cancer, un grand nombre de dérèglements biologiques se produit : les gènes mutent, les processus moléculaires changent considérablement et les cellules prolifèrent de manière incontrôlée pour former des tissus entièrement nouveaux appelés tumeurs. De nombreux éléments dysfonctionnent à différents niveaux. Cette complexité explique en partie la difficulté à étudier et à traiter le cancer.
Il va de soi que les chercheurs ciblent leur attention sur l’origine de tous les cancers : le génome. Si l’on parvient à comprendre ce qui se passe au niveau de l’ADN, alors un jour on pourra peut-être non seulement traiter, mais aussi prévenir les cancers.
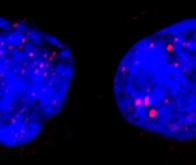
C’est ce qui a amené une équipe de chercheurs de l’EPFL et de l’Université de Lausanne (UNIL) à faire une découverte révolutionnaire sur une aberration génétique critique qui survient dans le cancer. Dans le cadre de leur collaboration, les équipes d’Elisa Oricchio (EPFL) et de Giovanni Ciriello (UNIL) ont utilisé une nouvelle méthode algorithmique pour comprendre comment les cellules cancéreuses réorganisent la structure 3D de leur ADN afin d’augmenter l’activité des gènes qui prédisposent au cancer, appelés «oncogènes».
La recherche porte sur les chromosomes, où est enfermé notre ADN, et leur manière de s’organiser dans l’espace étroit du noyau cellulaire. Étant donné que chacun des milliards de cellules de notre corps contient environ deux mètres d’ADN, on peut comprendre que nous ayons développé un mécanisme pour les stocker correctement. Ce mécanisme implique l’enroulement de l’ADN autour de protéines spéciales appelées histones, telle une ficelle embobinée autour d’un yoyo.
On obtient un complexe d’ADN et de protéines bien protégé et très enveloppé que l’on nomme chromatine. Plusieurs unités de chromatine constituent les structures que nous connaissons sous le nom de chromosomes. Normalement, chaque cellule porte 23 chromosomes et deux copies pour chaque chromosome. Or, dans le cancer, les cellules, leur structure et leur organisation, changent. Par exemple, un élément d’une copie du chromosome 8 peut être lié à une copie du chromosome 14. De plus, un chromosome peut prendre une structure plus détendue ou compacte, ce qui dépend de modifications chimiques appelées «marques épigénétiques ».
Les chercheurs ont étudié comment des changements des marques épigénétiques spécifiques modifient les structures chromosomiques et l’expression des gènes qui favorisent la croissance tumorale, connus sous le nom d’oncogènes.
L’équipe de Giovanni Ciriello de l’UNIL a mis au point une nouvelle approche algorithmique appelée Calder (d’après le sculpteur américain Alexander Calder) pour comprendre comment sont positionnées les régions génomiques les unes par rapport aux autres dans le noyau. « Nous avons utilisé Calder pour comparer l’organisation spatiale du génome dans plus de cent échantillons », explique Giovanni Ciriello. « Mais cette organisation n’est pas statique et, comme les sculptures mobiles d’Alexander Calder, les éléments peuvent être réagencés ». Les chercheurs ont eu recours à Calder pour détecter les régions de chromatine qui se sont «déplacées» d’une zone du noyau vers une autre à la suite de changements des marques épigénétiques.
Parallèlement, l’équipe d’Elisa Oricchio de l’EPFL a utilisé Calder pour détecter les changements de la structure 3D de la chromatine dans des cellules normales et des cellules de lymphome B. Elle a découvert que dans les cellules de lymphome, des changements épigénétiques spécifiques entraînent le repositionnement des régions de chromatine dans différentes zones du noyau, ce qui aboutit à de nouvelles interactions locales qui suractivent l’expression des oncogènes.
Elle a également découvert que, lorsque deux fragments de différents chromosomes sont rompus et échangés, ils adoptent une structure 3D qui se distingue des copies normales. Chose importante, ces changements de la structure 3D correspondent à différentes marques épigénétiques, et induisent une forte expression des gènes qui favorisent le développement de cellules tumorales.
« La plupart du temps, on imagine notre ADN comme une longue molécule linéaire. Ce n’est que récemment que nous avons commencé à comprendre comment son organisation 3D est modifiée dans les cellules cancéreuses », déclare Elisa Oricchio. « La prise en compte de l’organisation spatiale de l’ADN dans le noyau donne un nouvel angle pour comprendre comment les cellules tumorales apparaissent et comment la modulation thérapeutique des marques épigénétiques peut bloquer leur progression ».
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :
Un nouveau type de vaccin thérapeutique bloque le développement de certains cancers à un stade précoce
Des chercheurs de l’université de Vanderbilt (États-Unis) ont mis au point un nouveau type de vaccin anti-cancer destiné à combattre les tumeurs nouvellement développées. L’étude s’est portée sur ...
Asthme, un nouveau traitement britannique montre son efficacité
Des chercheurs britanniques travaillent sur l'élaboration d'un nouveau traitement contre l'asthme qui pourrait révolutionner les travaux sur la détresse respiratoire des 50 dernières années. En ...
Une avancée majeure contre les maladies rétiniennes
Un nouveau traitement prometteur vient d’être développé par une équipe du The Korea Institute of Science and Technology (KIST), qui permet de ralentir considérablement la progression des maladies ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :