Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
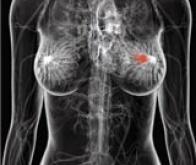
Cancer du sein métastatique : un nouveau traitement
- Tweeter
-
-
0 avis :
Ce nouveau médicament, le trastuzumab emtansine (T-DM1), combinaison d’un anticorps et d’un agent de chimiothérapie, a été conçu de manière à délivrer l’agent chimiothérapique directement à l’intérieur des cellules cancéreuses. Si les résultats finaux de cette étude EMILA de phase III ne sont pas encore matures, le laboratoire Roche communique néanmoins au 30 mars sur la capacité de son trastuzumab emtansine (T-DM1) à prolonger la survie sans progression chez les patientes atteintes de cancer du sein métastatique HER2-positif.
L’étude EMILIA, première étude randomisée de phase III sur le trastuzumab emtansine (T-DM1), montre que le trastuzumab emtansine prolonge significativement la survie sans progression des femmes souffrant de cancer du sein métastatique HER2-positif ayant déjà reçu un traitement par Herceptin et un taxane (chimiothérapie). Elle montre que les femmes traitées par le trastuzumab emtansine « ont vécu significativement plus longtemps sans aggravation de la maladie » vs les femmes traitées par lapatinib plus Xeloda (capécitabine). Le profil d’innocuité du trastuzumab emtansine s’est avéré correspondre à ceux observés lors de précédentes études.
Le trastuzumab emtansine est un produit expérimental connu sous le nom de conjugué anticorps-médicament (antibody-drug conjugate = ADC), composé du trastuzumab (anticorps) et du DM1 (agent de chimiothérapique) unis l’un à l’autre par un ligand stable, conçu pour cibler et inhiber la voie de signalisation de HER2 et délivrer l’agent chimiothérapique DM1 directement à l’intérieur des cellules cancéreuses HER2-positives.
“ (…) le trastuzumab emtansine est notre premier conjugué anticorps-médicament et il pourrait venir en aide aux personnes en attente de nouvelles options thérapeutiques contre cette maladie agressive. Nous allons tout mettre en œuvre pour que ces résultats soient présentés aux autorités réglementaires le plus vite possible », a précisé le Docteur Hal Barron, Chief Medical Officer et responsable de Global Product Development du laboratoire Roche. Roche prévoit en effet de déposer dès cette année auprès de l’Agence européenne des médicaments (EMA) une demande d’autorisation de mise sur le marché (AMM) et Genentech de même, à la U.S. Food and Drug Administration (FDA) pour le marché américain.
Noter cet article :
Vous serez certainement intéressé par ces articles :

Un complexe moléculaire propre aux femmes les expose aux maladies auto-immunes
Sclérose en plaques, diabète de type 1, lupus… sont des maladies auto-immunes. Ces maladies sont caractérisées par l’attaque des cellules saines du corps par le système immunitaire. Elles sont aussi ...
Une enzyme pour transformer le sang de tous les groupes sanguins en sang de donneur universel
On le sait, les stocks de sang sont régulièrement en tension, voire en pénurie, ce qui ne pas sans poser de graves problèmes pour les établissements de soin. Certains individus sont tout ...
Un vaccin expérimental contre le VIH donne enfin des résultats encourageants
Une étude synonyme d'espoir. Plus de 40 ans après la découverte du VIH, aucun vaccin n'a été mis au point contre ce virus responsable du Sida qui a causé la mort de millions de personnes. Mais un ...
Recommander cet article :
- Nombre de consultations : 723
- Publié dans : Biologie & Biochimie
- Partager :