Vivant
- Santé, Médecine et Sciences du Vivant
- Biologie & Biochimie
Cancer du pancréas : bloquer l’activité du gène KRAS…
- Tweeter
-
-
2 avis :
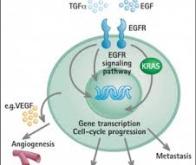
L’adénocarcinome pancréatique est l’une des tumeurs solides les plus agressives et mortelles, avec un taux de survie à 5 ans inférieur à 10 %. Un des facteurs qui contribuent à ce sombre pronostic est que ces cancers sont dans 95 % des cas déclenchés par l’activation de KRAS, un oncogène contre lequel il n’existe toujours pas de traitements spécifiques.
L’impact de cet oncogène est particulièrement dévastateur, car son activation reprogramme complètement le métabolisme de la cellule pour soutenir la croissance incontrôlée des cellules et assurer leur survie. En absence d’agents thérapeutiques spécifiques à KRAS, de nombreux efforts ont été consacrés au développement de médicaments dirigés contre d’autres enzymes cibles importantes qui participent à la croissance cellulaire stimulée par l’action de cet oncogène (comme l’enzyme MEK).
Malheureusement, ces enzymes jouent également des rôles très importants dans les cellules normales et leur blocage entraîne donc d’importants effets secondaires qui limitent l’utilisation de ces médicaments. En attendant l’arrivée d’anticancéreux capables de bloquer directement l’activité du gène KRAS, il devient donc extrêmement important d’améliorer la spécificité de ces médicaments.
Une étude récente suggère qu’un des moyens de cibler plus spécifiquement les cellules transformées par l’action de KRAS serait de tirer profit de la dépendance de ces cellules à la présence de fer. On sait depuis quelques années que le métabolisme du fer est complètement modifié dans les cellules cancéreuses contenant KRAS, avec notamment une hausse importante de l’ion ferreux, et que la présence de cet ion métallique semble représenter un facteur important pour la croissance et la survie des cellules cancéreuses ainsi que leur résistance à la chimiothérapie. Pour cibler spécifiquement les cellules cancéreuses contenant l’ion ferreux, une équipe de chercheurs a eu la brillante idée de modifier la structure chimique d’un médicament développé contre la MEK (le cobimetinib) en y ajoutant une petite molécule sensible à l’ion Fe2+.
En conditions normales, la présence de ce senseur inactive le médicament en l’empêchant d’interagir avec sa cible ; cependant, lorsque le conjugué pénètre dans une cellule cancéreuse contenant des quantités élevées d’ions ferreux, le senseur est détruit et le médicament ainsi libéré peut alors exercer son action inhibitrice. Autrement dit, cette approche devrait permettre de cibler spécifiquement la MEK présente dans les cellules cancéreuses transformées par KRAS et non celle retrouvée par les cellules normales, limitant ainsi les effets secondaires.
Et c’est exactement ce que les chercheurs ont observé : l’administration du conjugué à des animaux porteurs de tumeurs humaines a révélé que la molécule inhibait la kinase stimulée par le KRAS oncogénique seulement dans les cellules cancéreuses pancréatiques, sans aucun effet sur les cellules normales, et était donc beaucoup mieux tolérée que le médicament d’origine. Le ciblage spécifique du médicament vers les cellules cancéreuses a également permis aux chercheurs de combiner le médicament avec d’autres agents anticancéreux et d’ainsi améliorer l’efficacité du traitement, tout en minimisant les effets secondaires indésirables. Il s’agit donc d’une approche fort prometteuse, qui pourrait réduire substantiellement les ravages produits par les cancers causés par l’activation des oncogènes KRAS.
Article rédigé par Georges Simmonds pour RT Flash
Noter cet article :
Vous serez certainement intéressé par ces articles :
Un nouvel outil pour administrer le bon antibiotique à la bonne dose...
À Limoges, des chercheurs ont mis au point un outil capable de trouver, en quelques heures, le bon traitement pour le bon patient. Cette technologie prometteuse permettrait d'éviter des millions de ...

Le régime MIND semble réduire le vieillissement physique et cognitif
Une étude de l'Université Columbia à New York suggère qu'une alimentation saine peut ralentir les effets du vieillissement sur le corps humain, y compris sur le cerveau. Pour cette étude, les ...

Quand l'IA accélère le repositionnement des médicaments...
Un patient souffrant d'une forme grave de maladie de Castleman, une maladie rare hématologique, a pu parvenir à une rémission durable grâce à un repositionnement d'un traitement de maladies ...
Recommander cet article :
- Nombre de consultations : 0
- Publié dans : Biologie & Biochimie
- Partager :